以下是利用主要成分为Cu2S和Fe2O3的工业废弃固体(其他成分不参与反应)制备有关物质,实验流程如图所示:
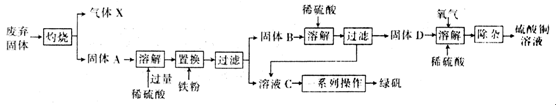
回答下列问题:
(1)气体X的化学式为 。
(2)加入铁粉时发生反应的离子方程式为:2H++Fe Fe2++H2↑、 。
Fe2++H2↑、 。
(3)常温下,固体D、O2和稀硫酸混合后几乎不反应,而加少量绿矾后随即发生反应。已知FeSO4对此反应起催化作用,则催化过程中反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O、 。
(4)除杂时需先加合适的氧化剂将Fe2+氧化为Fe3+,再加试剂Y调节溶液pH以除去Fe3+,则氧化剂及试剂Y可以是 (填编号)。
a.H2O2、CuO b.HNO3、Cu(OH)2
c.KMnO4、CuCl2 d.漂白粉、CuCO3
(5)无水硫酸铜受热分解生成氧化铜和气体,受热温度不同气体可能为SO3、SO2和O2中的一种、两种或三种。现设计如下实验测定产生的SO2、SO3和O2的物质的量,并计算各物质的化学计量数,从而确定CuSO4分解的化学方程式(已知实验结束时,硫酸铜完全分解)。
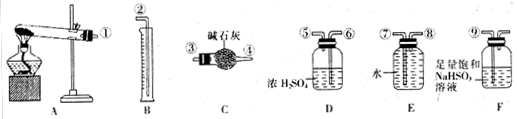
①仪器C的名称是 。
②组装探究实验的装置,按从左至右的方向,各仪器接口连接顺序为:
①→⑨→⑩→⑥→⑤→ → → → →②(填接口序号)。仪器F的作用是 。
③若某小组称取6.4g无水CuSO4,实验过程中装置C增加的质量为3.84g,量筒中水的体积折算成标准状况下气体体积224mL,请通过计算确定实验条件下CuSO4分解的化学方程式: 。
 HOI(aq)△H2
HOI(aq)△H2
 I3-(aq)。测得不同温度下该反应的平衡常数如图1所示,下列说法正确的是_____________。
I3-(aq)。测得不同温度下该反应的平衡常数如图1所示,下列说法正确的是_____________。 I3-(aq)的ΔH>0
I3-(aq)的ΔH>0









 粤公网安备 44130202000953号
粤公网安备 44130202000953号