(一)(1)钠及其化合物是中学化学常用物质,核潜艇或宇宙飞船常用过氧化钠做供氧剂,其原理是_______________________________、_______________________________(用化学方程式表示),若上述变化过程中消耗过氧化钠的质量为23.4g,则变化过程中转移电子数为_____________个。
(2)下列关于Na2O2的叙述正确的是__________
A.Na2O2中阴、阳离子的个数比为1∶1
B.Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等
C.取a g某物质在O2中完全燃烧,将生成物与足量Na2O2固体完全反应,反应后,固体质量恰好也增加了a g,该物质可能是C6H12O6
D.Na2O2的漂白原理与SO2的漂白原理相同
E.Na2O2与水反应是水作还原剂的氧化还原反应
F.Na2O2与NaHCO3固体按物质的量之比1:1混合加热充分反应后,所得固体中Na2CO3和NaOH的物质的量之比亦为1:1
(二)切开的金属Na暴露在空气中,其变化过程如下:

(1)反应Ⅰ的反应过程与能量变化的关系如右图:

① 反应Ⅰ 是 反应(填“放热”或“吸热”),判断依据是_________________________________。
②1 mol Na(s)全部氧化成Na2O(s)的热化学方程式是 _________________________________。
(2)白色粉末为Na2CO3。将其溶于水配制为0.1 mol/L Na2CO3溶液,下列说法正确的是 (填字母)。
A.升高温度,溶液的pH降低
B.c(OH-)-c (H+)=c (HCO3-)+2 c (H2CO3)
C.加入少量NaOH固体,c (CO32―)与c (Na+)均增大
D.c (Na+) > c (CO32―) > c (HCO3―) > c(OH―) > c (H+)
(3) 钠电池的研究开发在一定程度上可缓和因锂资源短缺引发的电池发展受限问题。
① 钠比锂活泼,用原子结构解释原因___________________________________。
②ZEBRA 电池是一种钠电池,总反应为NiCl2 + 2Na  Ni + 2NaCl。其负极反应式是____________
Ni + 2NaCl。其负极反应式是____________
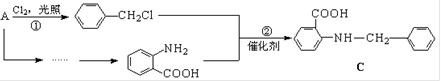
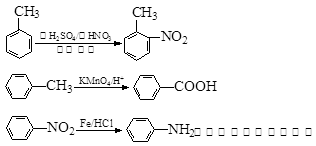
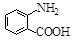 中官能团的名称。
中官能团的名称。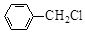 含苯环的同分异构体的结构简式。
含苯环的同分异构体的结构简式。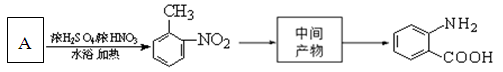
 粤公网安备 44130202000953号
粤公网安备 44130202000953号