(1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示。其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。
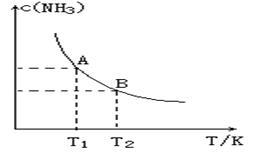
(1)当温度由T1变化到T2时,平衡常数关系K1 K2(填“>”,“<”或“=”),焓变△H 0。(填“>”或“<”)
(2)该反应在T1温度下5.0min达到平衡,这段时间内N2的化学反应速率为 。N2的转化率
(3)T1温度下该反应的化学平衡常数K1= 。
(4)500℃时,若测得高炉中c(N2)=0.5mol/L,c(H2)=0.5mol/L, c(NH3)=0.5mol/L在这种情况下,该反应是否处于平衡状态______(填是或否),此时反应速率是v正________v逆(填 >, <, =).
(5)根据最新研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:
2N2(g)+6H2O(l)=4NH3(g)+3O2(g),此反应的△S 0(填“>”或“<”)。
已知:①2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-a kJ·mol-1
②2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1;
③CO的燃烧热△H =-c kJ·mol-1。
写出消除汽车尾气中NO2的污染时,NO2与CO的反应的热化学反应方程式

 xC(g)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,试回答下列有关问题:
xC(g)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,试回答下列有关问题: 粤公网安备 44130202000953号
粤公网安备 44130202000953号