实验室用Na2SO3和70%硫酸溶液反应制取SO2,某研究性学习小组设计如下实验,制取并探究SO2的性质。(制取SO2反应原理为:Na2SO3+2H2SO4=Na2SO4+SO2↑+H2O)
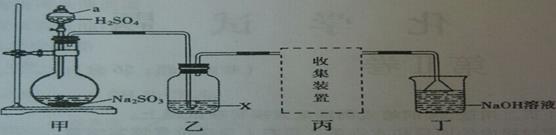
【探究实验】(1)甲装置中a仪器的名称是 。
(2)实验中若生成若生成标准状况下1.12LSO2,则需要Na2SO3 g参加反应。(已知:Na2SO3的摩尔质量为126g·mol-1)
(3)①若X是品红溶液,气体通过乙装置,观察到的现象是 ;
②若X是酸性KMnO4溶液,气体通过乙装置,观察到溶液褪色,说明SO2具有 。
A.酸性 B.还原性 C.漂白性
(4)丁装置中NaOH溶液的作用是吸收多余的SO2,请将其中反应的化学方程式补充完整:
 SO2 +
SO2 + NaOH =
NaOH =  +
+  H2O
H2O
【实验讨论】(5)若X是浓硫酸,用于干燥SO2气体,在丙处选用下图所示的收集装置,
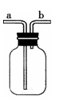
A、B两位同学的连接方式为:
A同学:SO2气体从a导管通入集气瓶中。
B同学:SO2气体从b导管通入集气瓶中。
正确的收集装置是 (填“A”或“B”)同学的连接方式。(已知:同等条件下SO2的密度大于空气)
【知识应用】
(6)向盛有水的烧杯中通入SO2,所得溶液的pH (填“>”或“=”或“<”)7。SO2是形成酸雨的主要物质,请你提出一种减少SO2对空气污染的可行措施: 。




 粤公网安备 44130202000953号
粤公网安备 44130202000953号