某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下: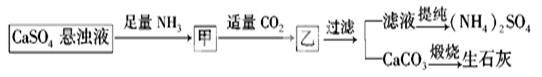
下列推断不合理的是
| A.往甲中通适量CO2有利于(NH4)2SO4生成 |
| B.生成1 mol(NH4)2SO4至少消耗2 molNH3 |
| C.CO2可被循环利用 |
| D.NH3、CO2的通入顺序可以互换 |
某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:
下列推断不合理的是
| A.往甲中通适量CO2有利于(NH4)2SO4生成 |
| B.生成1 mol(NH4)2SO4至少消耗2 molNH3 |
| C.CO2可被循环利用 |
| D.NH3、CO2的通入顺序可以互换 |