某温度下,对于反应N2(g)+3H2(g) 2NH3(g)△H=﹣92.4kJ/mol.N2的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是
2NH3(g)△H=﹣92.4kJ/mol.N2的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是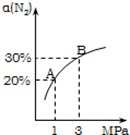
A.平衡状态由A变到B时,平衡常数K(A)<K(B)
B.将1.0mol氮气、3.0mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ
C.上述反应在达到平衡后,增大压强,H2的转化率提高
D.升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
某温度下,对于反应N2(g)+3H2(g) 2NH3(g)△H=﹣92.4kJ/mol.N2的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是
2NH3(g)△H=﹣92.4kJ/mol.N2的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是
A.平衡状态由A变到B时,平衡常数K(A)<K(B)
B.将1.0mol氮气、3.0mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ
C.上述反应在达到平衡后,增大压强,H2的转化率提高
D.升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小