将4 mol A 气体和2 mol B 气体在2 L 的密闭容器中混合并在一定条件下发生如下反应2A(g)+B(g)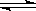 2C(g);△H <0。4 s(秒)后反应达到平衡状态,此时测得 C 的浓度为0.6 mol·L-1。下列说法中正确的是
2C(g);△H <0。4 s(秒)后反应达到平衡状态,此时测得 C 的浓度为0.6 mol·L-1。下列说法中正确的是
A.当A、B、C物质的量浓度之比为 2:1:2时,反应即达到平衡状态
B.4s内用物质B表示的反应速率为0.075 mol·L-1·s-1
C.达平衡后若通入一定量氦气,A的转化率降低
D.达平衡后若升高温度,C的浓度将增大
相关知识点
将4 mol A 气体和2 mol B 气体在2 L 的密闭容器中混合并在一定条件下发生如下反应2A(g)+B(g)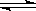 2C(g);△H <0。4 s(秒)后反应达到平衡状态,此时测得 C 的浓度为0.6 mol·L-1。下列说法中正确的是
2C(g);△H <0。4 s(秒)后反应达到平衡状态,此时测得 C 的浓度为0.6 mol·L-1。下列说法中正确的是
A.当A、B、C物质的量浓度之比为 2:1:2时,反应即达到平衡状态
B.4s内用物质B表示的反应速率为0.075 mol·L-1·s-1
C.达平衡后若通入一定量氦气,A的转化率降低
D.达平衡后若升高温度,C的浓度将增大