为了研究质量守恒定律,设计了下图“白磷燃烧前后质量测定”的实验,请分析有关问题: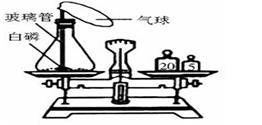
(1)装置:锥形瓶的底部铺有一层细沙,其作用是________________________;
(2)燃烧前称量,锥形瓶的总质量为27.6g,则右图托盘天平中游码的读数为__________g;
(3)白磷燃烧:白磷燃烧过程中看到的现象是____________________________;
(4)燃烧后称量:发现托盘天平指针偏向右边,造成的原因可能是_____________________。
为了研究质量守恒定律,设计了下图“白磷燃烧前后质量测定”的实验,请分析有关问题:
(1)装置:锥形瓶的底部铺有一层细沙,其作用是________________________;
(2)燃烧前称量,锥形瓶的总质量为27.6g,则右图托盘天平中游码的读数为__________g;
(3)白磷燃烧:白磷燃烧过程中看到的现象是____________________________;
(4)燃烧后称量:发现托盘天平指针偏向右边,造成的原因可能是_____________________。