H2S废气资源化利用途径之一是回收能量并得到单质硫。反应原理为:2H2S(g) + O2(g) = S2(s) + 2H2O(l) △H=-632kJ·mol-1。右图为质子膜H2S燃料电池的示意图。下列说法正确的是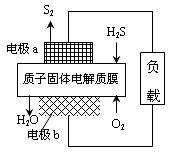
| A.电极a为电池的正极 |
B.电极b上发生的电极反应为:O2+2H2O+4e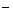 =" 4" OH =" 4" OH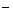 |
| C.电路中每流过4mol电子,电池内部释放632kJ热能 |
| D.每17gH2S参与反应,有1mol H+经质子膜进入正极区 |
H2S废气资源化利用途径之一是回收能量并得到单质硫。反应原理为:2H2S(g) + O2(g) = S2(s) + 2H2O(l) △H=-632kJ·mol-1。右图为质子膜H2S燃料电池的示意图。下列说法正确的是
| A.电极a为电池的正极 |
B.电极b上发生的电极反应为:O2+2H2O+4e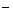 =" 4" OH =" 4" OH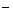 |
| C.电路中每流过4mol电子,电池内部释放632kJ热能 |
| D.每17gH2S参与反应,有1mol H+经质子膜进入正极区 |