合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)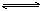 2NH3(g),500 K、30 MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示。
2NH3(g),500 K、30 MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示。
请回答下列问题:
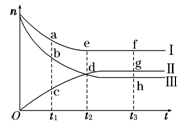
(1)上图中属于氢气物质的量随时间变化的曲线是 (填“Ⅰ”、“Ⅱ”或“Ⅲ”)。
(2)关于t2时刻的说法正确的是____________。
A.t2时该反应达到平衡状态
B.t2时Ⅱ和Ⅲ代表的物质反应速率相同
C.t2时氢气、氮气与氨气的反应速率之比为3∶1∶2
D.t2时氨气与氢气的物质的量相同
(3)对于Ⅱ所代表的物质,其逆反应速率最大的点是___________(填“c”、“d”或“g”);对于Ⅰ所代表的物质,其正反应速率最小的点是_____________(填“a”、“e”或“f”)。
(4)其他条件不变,只改变温度,在改变的这个温度下反应至t3时刻,此时n(H2)比图象中的值大,那么该温度可能是 。
A.673 K B.273 K C.373 K
(5)在密闭容器中充入2 mol N2和6 mol H2,一定条件下建立平衡:N2(g)+3H2(g)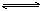 2NH3(g) ΔH=-92.2 kJ/mol,测得N2的转化率为90%,则在此条件下,反应放出的热量为 kJ。若与上述反应的温度和体积相同时,向密闭容器中充入4 mol NH3,则达平衡后,反应 (填“放出”或“吸收”)的热量为 kJ。
2NH3(g) ΔH=-92.2 kJ/mol,测得N2的转化率为90%,则在此条件下,反应放出的热量为 kJ。若与上述反应的温度和体积相同时,向密闭容器中充入4 mol NH3,则达平衡后,反应 (填“放出”或“吸收”)的热量为 kJ。


 粤公网安备 44130202000953号
粤公网安备 44130202000953号