已知热化学方程式H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3kJ/mol,
(1)实验室用0.25 L 0.10mol/L的一元强酸和强碱中和,若中和后溶液体积为0.5 L,中和后的溶液的比热容为4.2×10-3kJ/(g·℃),且密度为1.0g/mL,则溶液温度升高____________℃。
(2)将V1mL 1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是( )

A.做该实验时环境温度为22℃
B.该实验表明化学能可能转化为热能
C.NaOH溶液的浓度约为1.0mol/L
D.该实验表明有水生成的反应都是放热反应
(3)关于用水制取二级能源氢气,以下研究方向不正确的是( )
A.组成水的氢和氧都是可以燃烧的物质,因此可研究在不分解的情况下,使氢气成为二级能源
B.设法将太阳能聚焦产生高温,使水分解产生氢气
C.寻找催化剂使水分解,同时释放能量
D.寻找特殊化学物质用于开发廉价能源,以分解水取得能源
(4)在高温下一氧化碳可将二氧化硫还原为单质硫。
①C(s)+O2(g)===CO2(g)ΔH1=-393.5 kJ·mol-1
②CO2(g)+C(s)===2CO(g)ΔH2=+172.5 kJ·mol-1
③S(s)+O2(g)===SO2(g)ΔH3=-296.0 kJ·mol-1
请写出CO与SO2反应的热化学方程式: 。
 、 C:CH3COOH
、 C:CH3COOH
 和
和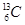
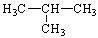
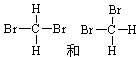
 粤公网安备 44130202000953号
粤公网安备 44130202000953号