合成氨工业的核心反应是N2(g)+3H2(g) 2NH3(g);反应过程中能量变化如图所示,回答下列问题。
2NH3(g);反应过程中能量变化如图所示,回答下列问题。

(1)该反应的ΔH=____________kJ/mol。
(2)在反应体系中加入催化剂,反应速率增大,E1的变化:E1__________(填“增大”、“减小”或“不变”)。
(3)在500℃、2×107Pa和催化剂条件下,向一密闭容器中充入0.5mol N2和1.5mol H2,充分反应后,放出的热量____________46.2 kJ (填“<”、“>”或“=”) 。
(4)关于该反应的下列说法中,正确的是________(填字母)。
| A.ΔH>0,ΔS>0 | B.ΔH>0,ΔS<0 |
| C.ΔH<0,ΔS>0 | D.ΔH<0,ΔS<0 |
(5)已知298K时白磷、红磷完全燃烧的热化学方程式分别为:
P4(s,白磷)+5O2(g)===P4O10(s) ΔH 1=-2983.2 kJ·mol-1
P(s,红磷)+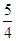 O2(g)===
O2(g)===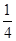 P4O10(s) ΔH 2=-738.5 kJ·mol-1
P4O10(s) ΔH 2=-738.5 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式为 。
 MnO4- +
MnO4- + 


 粤公网安备 44130202000953号
粤公网安备 44130202000953号