为证明Na2O2可作为潜水艇的供氧剂,某化学小组在实验室模拟CO2与Na2O2反应产生氧气的实验。
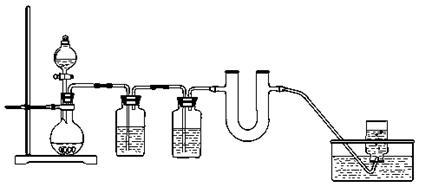
(1)生成CO2的化学反应方程式:
(2)饱和碳酸氢钠溶液的作用是除去CO2中混有的HCl气体,浓H2SO4的作用是
(3)u形管中的现象是 ,反应方程式为
为证明Na2O2可作为潜水艇的供氧剂,某化学小组在实验室模拟CO2与Na2O2反应产生氧气的实验。

(1)生成CO2的化学反应方程式:
(2)饱和碳酸氢钠溶液的作用是除去CO2中混有的HCl气体,浓H2SO4的作用是
(3)u形管中的现象是 ,反应方程式为