元素周期表的用途广泛。
(1)用“>”或“<”填空:
| 离子半径 |
非金属性 |
熔点 |
沸点 |
| K+_____S2- |
N____O |
金刚石_____晶体硅 |
HF____HCl |
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)。
a.Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d. HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液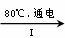 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体
①完成I中反应的总化学方程式:□NaCl+□H2O=□NaClO3+□ 。
②II中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其它晶体析出的原因是 。
(4)一定条件,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量(KJ)相对大小如右图所示。

①D是 (填离子符号)。
②B→A+C反应的热化学方程式为 (用离子符号表示)
 2LiI(s)△H
2LiI(s)△H

 一元酸HA溶液中
一元酸HA溶液中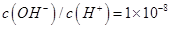 ,则溶液的pH=_____________。
,则溶液的pH=_____________。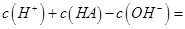 ____________mol·
____________mol· ,按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据如下表:
,按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据如下表:

 mol·
mol· b.
b. c.
c.

 粤公网安备 44130202000953号
粤公网安备 44130202000953号