(1)请用化学符号填空:
①地壳中含量最多的金属元素 ;②2个氢原子 ;③氧气 。
(2)某元素的原子结构示意图1,利用该元素组成的物质可测定空气中氧气的含量,实验装置如图2所示。①该元素原子的核电荷数为 ,在化学反应中该原子易 (填“得”或“失”)电子;
②图2所示装置中发生反应的文字表达式为
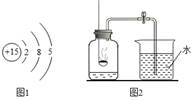
(1)请用化学符号填空:
①地壳中含量最多的金属元素 ;②2个氢原子 ;③氧气 。
(2)某元素的原子结构示意图1,利用该元素组成的物质可测定空气中氧气的含量,实验装置如图2所示。①该元素原子的核电荷数为 ,在化学反应中该原子易 (填“得”或“失”)电子;
②图2所示装置中发生反应的文字表达式为
