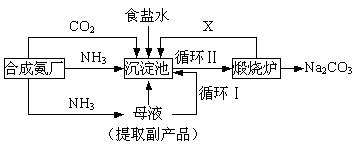
高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,工业上用难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),制备高纯六水氯化锶晶体的过程为:

已知: Ⅰ.SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
| 氢氧化物 |
Fe(OH)3 |
Fe(OH)2 |
| 开始沉淀的pH |
1.5 |
6.5 |
| 沉淀完全的pH |
3.7 |
9.7 |
(1)操作①加快反应速率的措施有 (写一种)。
碳酸锶与盐酸反应的化学方程式 。
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为 。
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为 。
A.氨水 B.氢氧化锶粉末 C.氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是 (填化学式)。
(5)步骤④的操作是 、 、过滤。
(6)工业上用热风吹干六水氯化锶但不能脱结晶水,适宜的温度是 。
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上


 个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定,溶液浓度相同)。
个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定,溶液浓度相同)。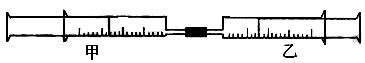
 。
。 l·L-1 NaOH溶液480 mL。配制方法如下:
l·L-1 NaOH溶液480 mL。配制方法如下: 溶液混合均匀;
溶液混合均匀;
 为
为 粤公网安备 44130202000953号
粤公网安备 44130202000953号