【2015年湖北省黄冈市】实验室常用下图所示的装置制取气体和气体性质的验证,请回答: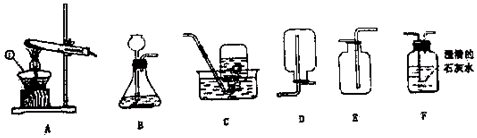
(1)仪器①的名称___________。
(2)图示装置中有明显错误的装置是______________(填序号)。
(3)实验室用高锰酸钾制取氧气,可选取的收集装置是_______(填序号),发生反应的化学方程式是__________________________________。
(4)某同学利用石灰石和盐酸通过装置B、F来验证二氧化碳的性质,实验过程中观察到F中有气泡冒出,澄清的石灰水未变浑浊,试分析其可能的原因______________________。

 滴加Ba(NO3)2溶液,产生白色沉淀,过滤,往沉淀中滴加稀硝酸,沉淀完全溶解。
滴加Ba(NO3)2溶液,产生白色沉淀,过滤,往沉淀中滴加稀硝酸,沉淀完全溶解。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号