已知2NO2(红棕色)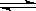 N2O4(无色)可以同时相互转化,
N2O4(无色)可以同时相互转化,
①在密封有NO2的玻璃瓶中,升高温度,颜色加深,问NO2转化为N2O4是一个 热反应。
②在一个恒温恒压容器中,通入稀有气体。颜色 ,平衡 移动。
③在一个密闭恒容体系中,增大NO2的量,会引起NO2转化率 ,颜色 ,再通入稀有气体增大压强,平衡 移动,颜色 。
已知2NO2(红棕色)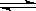 N2O4(无色)可以同时相互转化,
N2O4(无色)可以同时相互转化,
①在密封有NO2的玻璃瓶中,升高温度,颜色加深,问NO2转化为N2O4是一个 热反应。
②在一个恒温恒压容器中,通入稀有气体。颜色 ,平衡 移动。
③在一个密闭恒容体系中,增大NO2的量,会引起NO2转化率 ,颜色 ,再通入稀有气体增大压强,平衡 移动,颜色 。