现有反应CO(g)+2H2(g) CH3OH(g)过程中能量变化如下图所示,写出该反应的热化学方程式 ;
CH3OH(g)过程中能量变化如下图所示,写出该反应的热化学方程式 ;
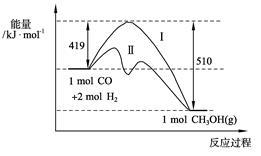
已知该反应中相关的化学键键能数据如下:
| 化学键 |
H—H |
C—O |
H—O |
C—H |
| E/(kJ·mol-1) |
436 |
343 |
465 |
413 |
则C≡O中的键能为 KJ·mol-1;图中曲线Ⅱ表示 (填反应条件)的能量变化。
现有反应CO(g)+2H2(g) CH3OH(g)过程中能量变化如下图所示,写出该反应的热化学方程式 ;
CH3OH(g)过程中能量变化如下图所示,写出该反应的热化学方程式 ;

已知该反应中相关的化学键键能数据如下:
| 化学键 |
H—H |
C—O |
H—O |
C—H |
| E/(kJ·mol-1) |
436 |
343 |
465 |
413 |
则C≡O中的键能为 KJ·mol-1;图中曲线Ⅱ表示 (填反应条件)的能量变化。