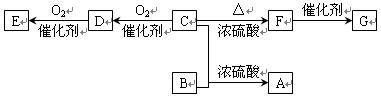
碳、氮及其化合物在工农业生产生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) = 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g) + 4NO(g) =" 2" N2(g)+CO2(g) + 2H2O(g) ΔH2
若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1734 kJ,则ΔH2= ;
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应如下:Fe2O3(s) + 3CH4(g)  2Fe(s) + 3CO(g) +6H2(g) ΔH>0
2Fe(s) + 3CO(g) +6H2(g) ΔH>0
① 若反应在5L的密闭容器中进行,1min后达到平衡,测得Fe2O3在反应中质量减少3.2g。则该段时间内CO的平均反应速率为 ________________ 。
② 若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是_____(选填序号)
a.CH4的转化率等于CO的产率
b.混合气体的平均相对分子质量不变
c.v(CO)与v(H2)的比值不变
d.固体的总质量不变
③ 该反应达到平衡时某物理量随温度变化如图所示,当温度由T1升高到T2时,平衡常数KA ______KB(填“>”、“ <”或“=”)。纵坐标可以表示的物理量有哪些 。
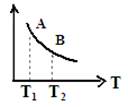
a.H2的逆反应速率
b.CH4的的体积分数
c.混合气体的平均相对分子质量
(3)若往20mL 0.0lmol·L-l的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是________
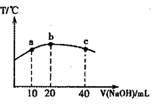
①该烧碱溶液的浓度为0.02mol·L-1
②该烧碱溶液的浓度为0.01mol·L-1
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH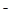 )> c(H+)
)> c(H+)

 和
和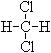 ;⑥
;⑥ 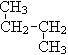 和
和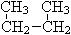
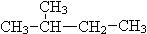
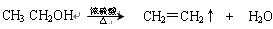
 粤公网安备 44130202000953号
粤公网安备 44130202000953号