将由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水,充分反应后得到12.6g白色沉淀,向所得的浊液中逐滴加入3mol/L的盐酸,生成沉淀的质量与加入盐酸的体积的关系如图所示: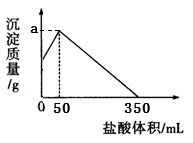
根据题意回答下列问题:
(1)写出将NaOH、AlCl3、MgCl2溶于水时发生反应的离子方程式: ___________
(2)a的值为__________
(3)求出原混合物各成分的物质的量(要求写出计算过程)
将由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水,充分反应后得到12.6g白色沉淀,向所得的浊液中逐滴加入3mol/L的盐酸,生成沉淀的质量与加入盐酸的体积的关系如图所示:
根据题意回答下列问题:
(1)写出将NaOH、AlCl3、MgCl2溶于水时发生反应的离子方程式: ___________
(2)a的值为__________
(3)求出原混合物各成分的物质的量(要求写出计算过程)