甲醇(CH3OH)是一种重要的化工原料,也是一种比较理想的燃料。甲醇在各个领域有着广泛的应用。
(1)实验测得:32 g甲醇在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出726.4 kJ的热量,试写出甲醇燃烧的热化学方程式:________________。
(2)燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。下图是一个化学过程的示意图。2CH3OH+3O2+4KOH K2CO3+6H2O
K2CO3+6H2O

①A(石墨)电极的名称是 。
②通入O2的电极的电极反应式是 。
③写出通入CH3OH的电极的电极反应式是 。
④乙池中反应的化学方程式为 。
⑤当电路中通过0.01mol电子时,丙池溶液的C(H+) = mol/L(忽略电解过程中溶液体积的变化)。
(3)合成甲醇的主要反应是:2H2(g)+ CO(g) CH3OH(g) △H=—90.8 kJ·mol—1。
CH3OH(g) △H=—90.8 kJ·mol—1。
①在恒温恒容条件下,充入一定量的H2和CO,发生反应2H2(g)+ CO(g) CH3OH(g)。则该反应达到平衡状态的标志有
CH3OH(g)。则该反应达到平衡状态的标志有
a.混合气体的密度保持不变
b.混合气体的总压强保持不变
c.CO的质量分数保持不变
d.甲醇的浓度保持不变
e.v正(H2)= v逆(CH3OH)
f.v(CO)= v(CH3OH)
②要提高反应2H2(g)+ CO(g) CH3OH(g)中CO的转化率,可以采取的措施是:
CH3OH(g)中CO的转化率,可以采取的措施是:
a.升温
b.加入催化剂
c.增加CO的浓度
d.加入H2
e.加入惰性气体
f.分离出甲醇
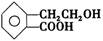 ,它可通过不同化学反应分别制得B、C、D和E四种物质。
,它可通过不同化学反应分别制得B、C、D和E四种物质。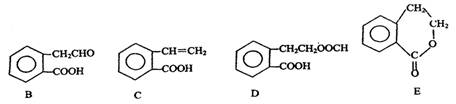
 粤公网安备 44130202000953号
粤公网安备 44130202000953号