如图是稀盐酸和氢氧化钠溶液反应过程中溶液酸碱度的变化情况。
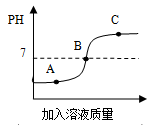
(1)该实验操作是将 滴加到另一种溶液中。
(2)A点时溶液中的溶质是 (填化学式)。
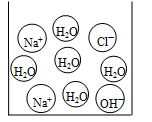
(3)右下图是反应中某时的微观图示,此时对应于上图中A、B、C中的哪一点? ;证明你的判断正确的实验操作方法是:向反应后的溶液中滴加 溶液。
如图是稀盐酸和氢氧化钠溶液反应过程中溶液酸碱度的变化情况。

(1)该实验操作是将 滴加到另一种溶液中。
(2)A点时溶液中的溶质是 (填化学式)。
(3)右下图是反应中某时的微观图示,此时对应于上图中A、B、C中的哪一点? ;证明你的判断正确的实验操作方法是:向反应后的溶液中滴加 溶液。
