(6分)根据结构对有机物进行分类,有助于对其性质的掌握。
①下列有机物属于芳香烃的是 (填字母),
a.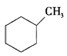 b.
b.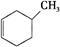 c.
c.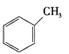
②下列有机物属于羧酸类的是 (填字母)。
a.CH3CHO b. c.
c.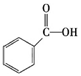
③下列有机物属于糖类的是 (填字母)。
a.油脂 b.纤维素 c.蛋白质
(6分)根据结构对有机物进行分类,有助于对其性质的掌握。
①下列有机物属于芳香烃的是 (填字母),
a. b.
b. c.
c.
②下列有机物属于羧酸类的是 (填字母)。
a.CH3CHO b. c.
c.
③下列有机物属于糖类的是 (填字母)。
a.油脂 b.纤维素 c.蛋白质