(14分)亚硫酸钠(Na2SO3)、漂白液(NaClO)和明矾[KAl(SO4)2∙12H2O]都是重要的化工产品,在日常生活和工业生产中都有广泛用途,且三者都可用在造纸业的不同生产工序中。
(1)NaClO做消毒液是它能与水反应产生一种强氧化性物质,写出该强氧化性物质的电子式_______。在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:____________。将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式 ____________。
(2)将饱和NaClO和KAl(SO4)2溶液混合,置于一只带单孔橡皮塞的大试管中,产生大量的白色胶状沉淀。此时反应的离子方程为____________。再将大试管置于阳光下照射,不久试管液面上方有浅黄绿色气体产生,将气体通入NaOH溶液充分吸收后,还能收集到一种无色无味的气体。写出在阳光照射下,混合液中反应的化学方程式____________。
若将KAl(SO4)2溶液换成硫酸亚铁铵【(NH4)2SO4∙FeSO4】溶液后,再与NaClO溶液混合,观察到大试管中有红褐色沉淀产生,同时溶液里现黄色,但没有气体生成。此时试管中发生反应的离子方程式为______。
(3)取一定体积KAl(SO4)2溶液于试管中,逐滴加入一定浓度的Ba(OH)2溶液, 直至产生沉淀的质量最大,写出此时的离子反应方程式____________。
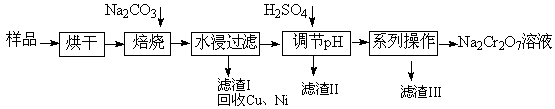
 Na2CrO4 + CO2 +H2O
Na2CrO4 + CO2 +H2O Cr2O72—+ H2O;②Na2Cr2O7、Na2CrO4在不同温度下的溶解度如下表
Cr2O72—+ H2O;②Na2Cr2O7、Na2CrO4在不同温度下的溶解度如下表
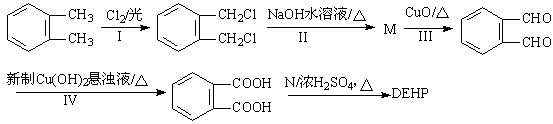
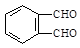 和足量的H2反应,最多可消耗H2mol。
和足量的H2反应,最多可消耗H2mol。 的反应得到
的反应得到 ,请写出该同分异构体的结构简式:。
,请写出该同分异构体的结构简式:。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号