如图所示,A、B、C、D、E 分别是铁、硝酸铜溶液、二氧化碳、稀硫酸溶液、氢氧化钠溶液中的一种,A是硝酸铜溶液(“—”相连两物质能发生反应)。请回答:
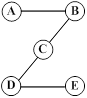
(1)D的化学式为 ,E物质的一种用途是 。
(2)A与B反应的化学方程式 ,基本反应类型是 。
(3)在不选用其它试剂的情况下, (填“能”或“不能”)依次鉴别出硝酸铜溶液、稀硫酸溶液、氢氧化钠溶液。
如图所示,A、B、C、D、E 分别是铁、硝酸铜溶液、二氧化碳、稀硫酸溶液、氢氧化钠溶液中的一种,A是硝酸铜溶液(“—”相连两物质能发生反应)。请回答:

(1)D的化学式为 ,E物质的一种用途是 。
(2)A与B反应的化学方程式 ,基本反应类型是 。
(3)在不选用其它试剂的情况下, (填“能”或“不能”)依次鉴别出硝酸铜溶液、稀硫酸溶液、氢氧化钠溶液。