减少污染、保护环境是全世界最热门的课题。
(1)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)==H2O(g) ΔH1=-241.8 kJ·mol-1
C(s)+1/2O2(g)===CO(g) ΔH2=-110.5 kJ·mol-1
则焦炭与水蒸气反应生成CO的热化学方程式为 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 (填序号):
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(2)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g)  CH3OH(g)。
CH3OH(g)。
在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。
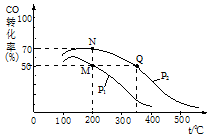
①M、N两点平衡状态下,容器中总物质的物质的
量之比为:n(M)总:n(N)总= 。
②若M、N、Q三点的平衡常数KM、KN、KQ的
大小关系为 。
(3)催化硝化法和电化学降解法可用于治理水中硝酸盐的污染。
①催化硝化法中,用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强。则该反应离子方程式为 。
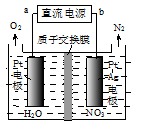
②电化学降解NO3-的原理如图所示,电源正极为 (填“a”或“b”);若总反应为4NO3-+4H+====5O2↑+2N2↑+2H2O,则阴极反应式为 。
 ,则ACl2的摩尔质量是;A的相对原子质量是;ACl2的化学式是。
,则ACl2的摩尔质量是;A的相对原子质量是;ACl2的化学式是。
 mol HCl的盐酸完全反应,则
mol HCl的盐酸完全反应,则 粤公网安备 44130202000953号
粤公网安备 44130202000953号