生铁是铁的合金,化学兴趣小组的同学为测定某生铁样品中铁的质量分数.进行如下实验:称取生铁样品5.8
放入烧杯中,逐滴加入稀硫酸,所加稀硫酸的质量与放出气体的质量关系如图所示(生铁样品中的杂质不与稀硫酸反应,也不溶于水).回答下列问题:
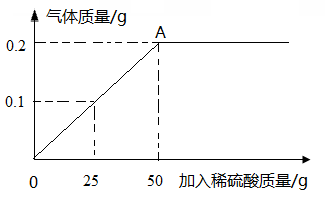
(1)当滴加稀硫酸质量为
(2)计算生铁样品中铁的质量分数(结果保留0.1
,下同).
(3)计算所用稀硫酸中溶质的质量分数.(温馨提示:
)
生铁是铁的合金,化学兴趣小组的同学为测定某生铁样品中铁的质量分数.进行如下实验:称取生铁样品5.8
放入烧杯中,逐滴加入稀硫酸,所加稀硫酸的质量与放出气体的质量关系如图所示(生铁样品中的杂质不与稀硫酸反应,也不溶于水).回答下列问题:

(1)当滴加稀硫酸质量为
(2)计算生铁样品中铁的质量分数(结果保留0.1
,下同).
(3)计算所用稀硫酸中溶质的质量分数.(温馨提示:
)