有下列几组物质,请将序号填入下列空格内:
| A.CH2=CH-COOH和油酸(C17H33COOH) |
| B.12C60和石墨 |
C.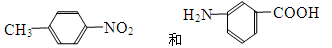 |
| D.35Cl和37Cl |
E.乙醇和乙二醇
(1)互为同位素的是 ;
(2)互为同系物的是 ;
(3)互为同素异形体的是 ;
(4)互为同分异构体的是 ;
(5)既不是同系物,又不是同分异体,也不是同素异形体,但可看成是同一类物质的是 。
有下列几组物质,请将序号填入下列空格内:
| A.CH2=CH-COOH和油酸(C17H33COOH) |
| B.12C60和石墨 |
C.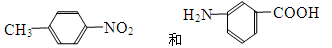 |
| D.35Cl和37Cl |
E.乙醇和乙二醇
(1)互为同位素的是 ;
(2)互为同系物的是 ;
(3)互为同素异形体的是 ;
(4)互为同分异构体的是 ;
(5)既不是同系物,又不是同分异体,也不是同素异形体,但可看成是同一类物质的是 。