在50mLH2O2水溶液中加入2g二氧化锰,在标准状况下放出气体的体积与时间的关系如图所示: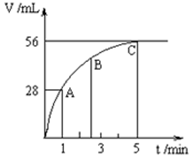
(1)该反应还可用____________代替二氧化锰做催化剂加快反应速率。
(2)A、B、C各点所表示的反应速率由快到慢的顺序为_____________________。试解释反应速率变化的原因是___________________。
(3)该H2O2水溶液的物质的量浓度为____________________。
在50mLH2O2水溶液中加入2g二氧化锰,在标准状况下放出气体的体积与时间的关系如图所示:
(1)该反应还可用____________代替二氧化锰做催化剂加快反应速率。
(2)A、B、C各点所表示的反应速率由快到慢的顺序为_____________________。试解释反应速率变化的原因是___________________。
(3)该H2O2水溶液的物质的量浓度为____________________。