在2SO2+O2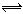 2SO3的反应里,开始SO2和O2的浓度均为0.5mol·L-1,2分钟后测得SO2的浓度为0.25mol·L-1,则v(O2)=________________,各物质所表示的反应速率的最简整数比v(SO2):v(SO3):v(O2)= 。
2SO3的反应里,开始SO2和O2的浓度均为0.5mol·L-1,2分钟后测得SO2的浓度为0.25mol·L-1,则v(O2)=________________,各物质所表示的反应速率的最简整数比v(SO2):v(SO3):v(O2)= 。
在2SO2+O2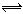 2SO3的反应里,开始SO2和O2的浓度均为0.5mol·L-1,2分钟后测得SO2的浓度为0.25mol·L-1,则v(O2)=________________,各物质所表示的反应速率的最简整数比v(SO2):v(SO3):v(O2)= 。
2SO3的反应里,开始SO2和O2的浓度均为0.5mol·L-1,2分钟后测得SO2的浓度为0.25mol·L-1,则v(O2)=________________,各物质所表示的反应速率的最简整数比v(SO2):v(SO3):v(O2)= 。