A—F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:
元素
|
结构或性质
|
A
|
原子最外层电子数是内层电子总数的1/5
|
B
|
形成化合物种类最多的元素,其单质为固体
|
C
|
生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5
|
D
|
地壳中含量最多的元素
|
E
|
与D同主族
|
F
|
与E同周期,且最外层电子数等于电子层数
|
请回答下列问题:
(1)A在元素周期表中的位置是 ;A与E形成的化合物的电子式是 。
(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是 。
(3)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是 。
(4)F的盐酸盐水溶液呈酸性,原因是 (用离子方程式表示);F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是 。
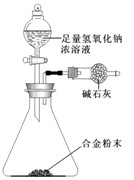
(5)A与F形成的合金是重要的工业材料。某同学仅使用天平和上图所示的装置,粗略测定某些数据即可求出该合金中A元素的含量。(装置中因空气质量引起的误差忽略不计)
①实验需要测定三个物理量:合金的质量m以及a和b。
a是 ;b是 。
②合金中A元素的质量分数是 (用含m、a、b的式子表示)。