(12分) 结合下列实验装置回答相关问题:
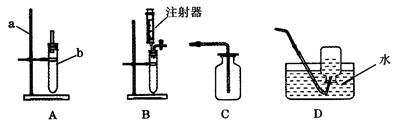
(1)实验室用石灰石与稀盐酸反应制CO2的化学方程式为:____________,收集装置应选________(填编号);
实验室用双氧水制O2的化学方程式为:_________________________________。
(2)若用B作制气装置,与A相比,其优点是_________________________(写一点)。
(3)用KClO3和MnO2制O2,若选用A作发生装置,则还要增加_________________(填仪器名称),并把A作如下改动:____________________________。发生反应的化学方程式为: ___________________。