(6分)按要求回答下列问题
(1)已知反应:mA(g) + nB(g)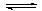 pC(g) + qD(g),v(A):v(B)= _________________;
pC(g) + qD(g),v(A):v(B)= _________________;
(2)任何情况下判断水溶液呈中性的依据是:_______________;
(3)NH4Cl溶液中离子浓度由大到小的顺序是:_________________。
(6分)按要求回答下列问题
(1)已知反应:mA(g) + nB(g)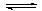 pC(g) + qD(g),v(A):v(B)= _________________;
pC(g) + qD(g),v(A):v(B)= _________________;
(2)任何情况下判断水溶液呈中性的依据是:_______________;
(3)NH4Cl溶液中离子浓度由大到小的顺序是:_________________。