【2015海南化学】单质Z是一种常见的半导体材料,可由X通过如下图所示的路线制备,其中X为Z的氧化物,Y为氢化物,分子结构与甲烷相似,回答下列问题:
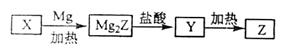
(1)能与X发生化学反应的酸是 ;由X制备Mg2Z的化学方程式为 。
(2)由Mg2Z生成Y的化学反应方程式为 ,Y分子的电子式为 。
(3)Z、X中共价键的类型分别是 。
【2015海南化学】单质Z是一种常见的半导体材料,可由X通过如下图所示的路线制备,其中X为Z的氧化物,Y为氢化物,分子结构与甲烷相似,回答下列问题:

(1)能与X发生化学反应的酸是 ;由X制备Mg2Z的化学方程式为 。
(2)由Mg2Z生成Y的化学反应方程式为 ,Y分子的电子式为 。
(3)Z、X中共价键的类型分别是 。