氯化钠是氯碱工业的主要原料,其晶体不带有结晶水,饱和食盐水也是实验室常用试剂。完成下列填空:
(1)粗盐中含有Ca2+、Mg2+、SO42―等离子和少量泥沙,某同学设计的提纯步骤依次为:溶解、过滤、加入沉淀剂、调pH、蒸发结晶。其中还缺少的步骤是_________。
(2)电解饱和食盐水实验中,检验阳极产物的试剂是________________;若用粗盐配制饱和食盐水进行电解,则阴极区可能出现的异常现象是_________________。
(3)氯碱厂称固体烧碱为“片碱”。用滴定法测定片碱中杂质Na2CO3含量的过程如下:
称取样品,加水溶解;加入酚酞试液,用标准盐酸滴定至溶液由红色刚好变为无色;再加甲基橙,继续用标准盐酸滴定至终点。数据处理。实验中用于溶解片碱的蒸馏水必须事先煮沸一段时间,煮沸的目的是_______;用甲基橙作指示剂时,判断滴定达到终点的现象是________________;用酚酞作指示剂时,发生反应的离子方程式为_________________。
(4)下列关于饱和食盐水的用途及装置设计正确的是_________(填写编号)。

a.模拟工业制纯碱 b.制乙酸乙酯实验中接受产物
c.除去氯气中的氯化氢 d.实验室制乙炔
(5)在饱和食盐水中加入浓硫酸,会有大量固体析出。过滤、洗涤、得干燥固体。为确定该固体的成份,进行以下实验:①取少量固体溶于水,测得溶液显中性;
②称取1.961 g固体于坩埚中加热,发现有水生成,继续加热至固体恒重,称量质量为1.331 g。判断固体已恒重的操作是____________________;
③将1.331 g固体全部溶于水,加入足量的BaCl2溶液,得干燥纯净沉淀1.165 g。则原固体的成份是______________(写化学式)。


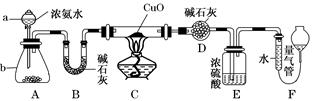

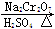 CH3CH2CH2CHO
CH3CH2CH2CHO
 粤公网安备 44130202000953号
粤公网安备 44130202000953号