重晶石矿的主要成分为硫酸钡(BaSO4),纯净的硫酸钡才能作为医用“钡餐”。工业上用重晶石矿制硫酸钡的流程如下:
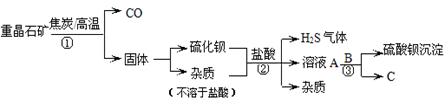
(1)步骤①中,生成的一氧化碳具有炼铁和 等用途;生成的硫化钡中硫元素的化合价为-2,写出硫化钡的化学式 。
(2)已知步骤②、③均为为复分解反应。反应②的化学方程式是 ,若C在该生产过程中可循环使用,则B的化学式是 。
重晶石矿的主要成分为硫酸钡(BaSO4),纯净的硫酸钡才能作为医用“钡餐”。工业上用重晶石矿制硫酸钡的流程如下:

(1)步骤①中,生成的一氧化碳具有炼铁和 等用途;生成的硫化钡中硫元素的化合价为-2,写出硫化钡的化学式 。
(2)已知步骤②、③均为为复分解反应。反应②的化学方程式是 ,若C在该生产过程中可循环使用,则B的化学式是 。