下列解释实验事实的离子方程式正确的是
| A.用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
| B.漂白粉溶液中通入过量的SO2:ClO-+SO2+H2O=HClO+HSO3- |
| C.酸性KI淀粉溶液久置后变蓝:4l-+O2+4H+=2I2+2H2O |
D.Na2S溶液使酚酞试液变红:S2-+2H2O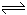 2OH-+H2S 2OH-+H2S |
下列解释实验事实的离子方程式正确的是
| A.用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
| B.漂白粉溶液中通入过量的SO2:ClO-+SO2+H2O=HClO+HSO3- |
| C.酸性KI淀粉溶液久置后变蓝:4l-+O2+4H+=2I2+2H2O |
D.Na2S溶液使酚酞试液变红:S2-+2H2O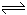 2OH-+H2S 2OH-+H2S |