亚硝酸钠是一种工业盐,用途广泛,外观与食盐非常相似,但毒性较强,食品添加亚硝酸钠必须严格控制用量。某化学兴趣小组对食盐与亚硝酸钠进行了如下探究:
(一)鉴别NaCl和NaNO2
(1)测算溶液pH
常温下,用pH试纸分别测定0.1 mol·L-1两种盐溶液的pH,测得NaNO2溶液呈碱性。
NaNO2溶液呈碱性的原因是________________(用离子方程式解释)。
NaNO2溶液中HNO2的准确浓度为________mol·L-1(测得NaNO2溶液pH=b,用含b的代数式表示)。
(2)沉淀法
取2 mL 0.1mol·L-1两种盐溶液于试管中,分别滴加几滴稀硝酸银溶液,两只试管均产生白色沉淀,分别滴加几滴稀硝酸并振荡,盛NaNO2溶液的试管中沉淀溶解。
该温度下Ksp(AgNO2)=1.8×10-8(mol2/L2);Ksp(AgCl)=1.8×10-10(mol·L-1)2
则反应AgNO2(s)+Cl-(aq) AgCl(s)+NO2-(aq)的化学平衡常数K=________。
AgCl(s)+NO2-(aq)的化学平衡常数K=________。
(3)氧化法
取2 mL 0.1mol·L-1两种盐溶液于试管中,分别滴加几滴酸性KMnO4溶液,使酸性KMnO4溶液褪色的是NaNO2溶液。该反应的离子方程式为______________________________。
(二)NaNO2性质探究
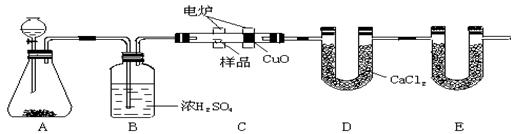
该兴趣小组同学用下图装置探究亚硝酸钠与硫酸反应及气体产物成分。
已知:气体的液化温度:NO221℃、NO–152℃
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):A→_______→_________→_________→_________;组装好仪器后,接下来须进行的操作是_________________。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气。
(3)关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸溶液后,A中产生红棕色气体。
①如何验证A中产生的气体中含有NO_________。(写出实验操作、现象和结论)
②装置E的作用是_____________________________。
③A装置中发生反应的化学方程式为_________________________________________。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号