A~G是几种烃分子的球棍模型(如图),据此回答下列问题: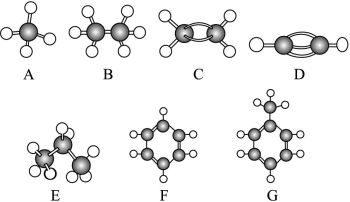
(1)常温下含碳量最高的气态烃是(填对应字母)________________;
(2)能够发生加成反应的烃有(填数字)________种;
(3)一卤代物种类最多的是(填对应字母)__________;
(4)写出C发生加聚反应的化学方程式:______________________;
(5)写出F发生溴代反应的化学方程式:______________________。
A~G是几种烃分子的球棍模型(如图),据此回答下列问题:
(1)常温下含碳量最高的气态烃是(填对应字母)________________;
(2)能够发生加成反应的烃有(填数字)________种;
(3)一卤代物种类最多的是(填对应字母)__________;
(4)写出C发生加聚反应的化学方程式:______________________;
(5)写出F发生溴代反应的化学方程式:______________________。