(15分)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,常用于水的消毒杀菌和织物的漂白。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下: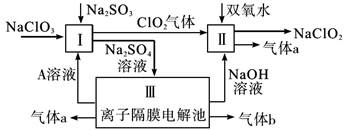
(1)反应I中的Na2SO3长期存放通常含有Na2SO4杂质,可用滴定法测定Na2SO3的纯度,向Na2SO3溶液中滴加酸性KMnO4溶液,酸性KMnO4溶液应使用_________滴定管,滴定前,若该滴定管尖嘴处有气泡存在,赶除气泡的操作方法为____________________。
(2)Ⅱ中反应的离子方程式是_____________________________________________。
(3)A的化学式是________________,装置Ⅲ中b在极区产生______________________。
(4)已知ClO2对污水中CN-等有明显的去除效果,某工厂污水中含CN-amg/L,现用ClO2将CN-氧化生成两种无毒的气体,自身被还原为Cl-;该反应离子方程式为_____________;处理100m3这种污水,至少需要ClO2的质量为_______g(保留到小数点后一位)。
(5)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
| 弱酸 |
HClO2 |
HF |
HCN |
H2S |
| Ka |
1×10-2 |
6.3×10-4 |
4.9×10-10 |
K1=9.1×10-8 K2=1.1×10-12 |
常温下,物质的量浓度相等的NaClO2、NaF、NaCN、Na2S四种溶液的pH由大到小的顺序为__________;体积相等、物质的量浓度相同的NaClO2、NaCN两溶液中所含阴阳离子总数的大小关系为________(填“前者大”、“相等”或“后者大”)。


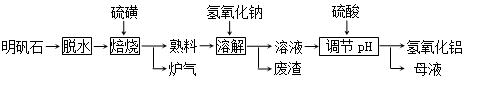
 2Al 2O3+9SO2,其中氧化剂为 。
2Al 2O3+9SO2,其中氧化剂为 。 粤公网安备 44130202000953号
粤公网安备 44130202000953号