(1)室温下,如果将0.1molCH3COONa和0.05molHCl全部溶于水,形成混合溶液(假设无损失), 和 两种粒子的物质的量之和等于0.1mol。
(2)已知某溶液中只有Na+、CH3COO-、H+、OH-四种离子。某同学推测该溶液中离子浓度可能有如下四种关系:
A.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.c(Na+)>c(CH3COO-)>c(H+) >c(OH-)
C.c(Na+)>c(OH-)> c(CH3COO-)>c(H+)
D.c(CH3COO-)>c(Na+)>c(H+) >c(OH-)
①若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小关系中正确的是(填序号) ;
②若上述关系中D是正确的,则溶液中溶质的化学式是 ;
③若该溶液由体积相等的醋酸与NaOH溶液混合而成,且溶液恰好呈中性,则混合前c(CH3COOH)(填“>”“<”“=”,下同) c(NaOH),混合后c(CH3COO-)与c(Na+)的关系是c(CH3COO-) c(Na+)。
(3)25℃时,向0.1mol/L的醋酸溶液中加入少量的醋酸钠固体,当固体溶解后,测得溶液的pH增大,主要原因是 (填序号)
A.醋酸与醋酸钠发生反应
B.醋酸钠溶液水解显碱性,增加了c(OH-)
C.醋酸钠溶于水电离出醋酸根离子,抑制了醋酸的电离,使c(OH-)减小。

 2NiO(OH) + H2放电时,正极的电极反应式为 ,充电时,该电极应与电源的 (填“正”或“负”)极相连。
2NiO(OH) + H2放电时,正极的电极反应式为 ,充电时,该电极应与电源的 (填“正”或“负”)极相连。 2NH3(g)△H= —92.4kJ·mol-1,2H2(g)+O2(g)
2NH3(g)△H= —92.4kJ·mol-1,2H2(g)+O2(g) 2H2O(l) ΔH="-572" kJ·mol-1,则氨在空气中燃烧生成液态水和氮气时的热化学方程式为: 。
2H2O(l) ΔH="-572" kJ·mol-1,则氨在空气中燃烧生成液态水和氮气时的热化学方程式为: 。 CuO
CuO 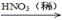 Cu(NO3)2
Cu(NO3)2 2SO3(g)ΔH<0一定温度下,向1 L恒容密闭容器中充入5 mol SO2 和3 mol O2,反应达到平衡时有3 mol SO3(g)生成。试回答下列问题:
2SO3(g)ΔH<0一定温度下,向1 L恒容密闭容器中充入5 mol SO2 和3 mol O2,反应达到平衡时有3 mol SO3(g)生成。试回答下列问题: 粤公网安备 44130202000953号
粤公网安备 44130202000953号