现有A、B、C三种烃,其球棍模型如下图: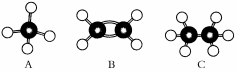
(1)分别取上述三种物质完全燃烧,生成水物质的量是二氧化碳物质的量的两倍的是_____(填序号)。
(2)与A和C是同系物,分子中碳原子数介于4到10的该系列物质,它们的核磁共振氢谱只有一种峰,它们的结构简式分别是____________、____________。
(3)A的同系物D在一定条件下形成的碳正离子: ,它是有机反应中重要的中间体,
,它是有机反应中重要的中间体,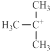 失去一个
失去一个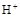 后将生成B的同系物F,F的结构简式为_________。
后将生成B的同系物F,F的结构简式为_________。
现有A、B、C三种烃,其球棍模型如下图:
(1)分别取上述三种物质完全燃烧,生成水物质的量是二氧化碳物质的量的两倍的是_____(填序号)。
(2)与A和C是同系物,分子中碳原子数介于4到10的该系列物质,它们的核磁共振氢谱只有一种峰,它们的结构简式分别是____________、____________。
(3)A的同系物D在一定条件下形成的碳正离子: ,它是有机反应中重要的中间体,
,它是有机反应中重要的中间体, 失去一个
失去一个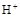 后将生成B的同系物F,F的结构简式为_________。
后将生成B的同系物F,F的结构简式为_________。