(1)按系统命名法命名:
①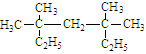 ;
;
②(CH3)2CHCH=CHCH3___________________________;
(2)写出下列各有机物的结构简式:
①2,3-二甲基-4-乙基已烷:_______________________________;
②支链只有一个乙基且相对分子质量最小的烷烃:___________________;
(1)按系统命名法命名:
①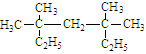 ;
;
②(CH3)2CHCH=CHCH3___________________________;
(2)写出下列各有机物的结构简式:
①2,3-二甲基-4-乙基已烷:_______________________________;
②支链只有一个乙基且相对分子质量最小的烷烃:___________________;