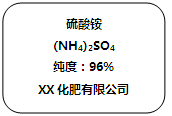
为测定某氮肥中硫酸铵的纯度(及质量分数)是否与下图标签相符合,小林取15g该氮肥样品配成溶液,加入足量氯化钡溶液充分反应后,过滤、洗涤、烘干,测得沉淀质量为23.3g。试通过计算确定该氮肥中硫酸铵的纯度是否与标签相符。
【反应的化学方程式为
,其他成分能溶于水但不参加反应】
为测定某氮肥中硫酸铵的纯度(及质量分数)是否与下图标签相符合,小林取15g该氮肥样品配成溶液,加入足量氯化钡溶液充分反应后,过滤、洗涤、烘干,测得沉淀质量为23.3g。试通过计算确定该氮肥中硫酸铵的纯度是否与标签相符。

【反应的化学方程式为
,其他成分能溶于水但不参加反应】