A、B、C、D四种物质之间有下图所示的转化关系。已知:A是空气中的主要成分,B、C、D均为化合物,且C为红棕色气体。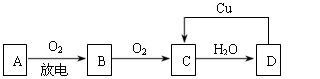
请回答下列问题:
(1)写出A和C的名称或化学式: A ,C ;
(2)在上图D→C的过程中,D表现出强 (填“氧化性”或“还原性”);
(3)在D的稀溶液中滴入NaOH溶液,其反应的离子方程式是 。
A、B、C、D四种物质之间有下图所示的转化关系。已知:A是空气中的主要成分,B、C、D均为化合物,且C为红棕色气体。
请回答下列问题:
(1)写出A和C的名称或化学式: A ,C ;
(2)在上图D→C的过程中,D表现出强 (填“氧化性”或“还原性”);
(3)在D的稀溶液中滴入NaOH溶液,其反应的离子方程式是 。