(15分)某工业废料钡泥中主要含有BaCO3、BaSO3、Ba(FeO2)2等,某实验小组模拟工业过程利用钡泥制取BaCO3和Ba(NO3)2晶体(不含结晶水),其实验流程如下: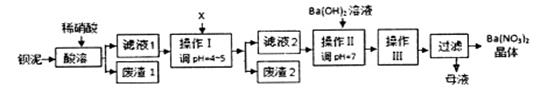
已知:
①Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分虽为3.2和9.7;
②Ba(NO3)2晶体的分解温度:592℃; Ba(NO3)2的溶解度在高温时较大,低温时较小;
③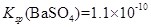 ,
,  .
.
(1)酸溶时,BaCO3发生反应的离子反应方程式为___________________________________
(2)酸溶后,滤液1除了Ba2+外,还存在的阳离子是____________________等(填写离子符号)。
(3)加入X的目的是_______________________________________________。
(4)若在操作II中加入Na2CO3来制取BaCO3,经检验所得BaCO3中含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌和静置后,弃去上层清液。如此反复多次处理,直到BaSO4全部转化为BaCO3,该提纯原理的离子反应方程式是_______________________________________
(5)若用(4)的方法处理含有0.21mol BaSO4样品,每次用1.0 L 2.0mol·L-1饱和Na2CO3溶液,则至少需要处理________次,BaSO4才能全部转化BaCO3。
(6)操作III的名称是:________、冷却结晶、_________、洗涤、干燥。
(7)上述流程中对环境的影响主要有_________。因此要进一步处理,避免造成二次污染。

 含量较高,必须添加钡试剂除去SO
含量较高,必须添加钡试剂除去SO


 粤公网安备 44130202000953号
粤公网安备 44130202000953号