固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g) CH3OH(g)+H2O(g)+ 49kJ
CH3OH(g)+H2O(g)+ 49kJ
某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。a,b,c,d括号内数据表示坐标。
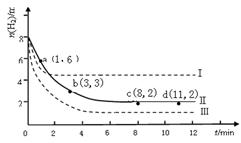
(1)a点正反应速率_______(填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是___________。
A.0~1min B.1~3min C.3~8min
(3)仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是___________,曲线III对应的实验条件改变是_________。
(4)比较以上三种不同状态下的平衡常数大小(用KⅠ、KⅡ、KⅢ表示)。
(5)若在开始时,科学实验将3molCO2和4molH2充入2L的密闭容器中,其他条件不变,达平衡后氢气的物质的量n1mol(填大于,小于或等于)。