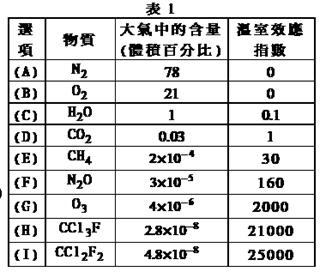
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①反应开始到平衡,H2的平均反应速率v(H2)=_________________mol/(L·min),
②H2的转化率为 ____________。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
| A.升高温度 |
| B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 |
| D.再充入1mol CO2和3mol H2 |
E、使用催化剂
F、缩小容器体积
(2)①反应进行到3 min时,同种物质的v正 与v逆的关系: v正 v逆 (填>,=,<)
②上述反应平衡常数的表达式为 ,经计算该温度下此反应平衡常数的数值为 。
 性异构
性异构
 aO晶胞体积为cm3
aO晶胞体积为cm3 定比例Li2CO3和Na2CO3熔融混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1:1)直接作燃料,其工作原理如图所示。
定比例Li2CO3和Na2CO3熔融混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1:1)直接作燃料,其工作原理如图所示。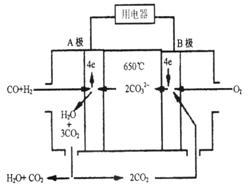
 此电源电
此电源电 解足量的CuSO4溶液,阳极产生气体0.56 L(已换算为标况),则阴极产物的质量为g。电解后溶
解足量的CuSO4溶液,阳极产生气体0.56 L(已换算为标况),则阴极产物的质量为g。电解后溶 液体积为1 L,溶液的pH约为。
液体积为1 L,溶液的pH约为。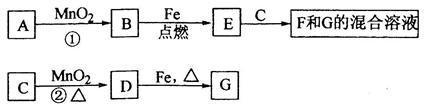
 粤公网安备 44130202000953号
粤公网安备 44130202000953号