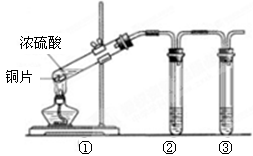
某学习小组探究铜跟浓硫酸反应的情况。取6.4g铜片和10mL 18mol·L-1的浓硫酸放在圆底烧瓶中,按下图所示装置进行实验。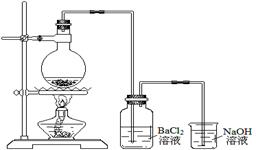
(1)铜和浓硫酸反应的化学方程式为 。
(2)实验结束后,发现广口瓶中产生白色沉淀,加入足量盐酸后沉淀几乎完全溶解。简要分析广口瓶中产生沉淀的主要原因: 。
(3)实验结束后,发现烧瓶中有铜片剩余。根据所学知识,他们认为烧瓶中还有较多的硫酸剩余。选择合适的试剂,设计简单易行的实验方案证明有余酸: 。
供选择的试剂:铁粉、银粉、BaCl2溶液、Na2CO3溶液
(4)甲同学设计如下方案:测定产生气体的量,再计算余酸的浓度。下列测定产生气体的量的实验方法中,不可行的是 (填编号)。
a.将气体缓缓通过预先称量、盛有碱石灰的干燥管,反应结束后再次称量
b.将气体通入硫酸酸化的KMnO4溶液,再加足量BaCl2溶液,过滤、洗涤、干燥,称量沉淀
c.用排水法测定产生气体的体积
d.用排饱和NaHSO3的方法测定产生气体的体积
(5)乙同学设计通过酸碱中和滴定来测定余酸的浓度:待烧瓶冷却至室温后,将其中的溶液用蒸馏水稀释至100mL,移取25mL到锥形瓶中,滴加2滴酚酞试液,用标准NaOH溶液滴至终点。平行实验三次。
①稀释时,应先往 (填仪器名称)中加入 (填“烧瓶中的溶液”或“蒸馏水”)。
②该方法测得的余酸浓度 (填“偏大”、“偏小”或“准确”)。
(6)丙设计了测定余酸浓度的较为简易的实验方案:取出反应后剩余的铜片,进行洗涤、干燥、称量。若称得剩余铜片的质量为3.2g,反应后溶液体积变化忽略不计,则剩余硫酸的物质的量浓度为____。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号